- Цена: US $2.53
- Живьем
- Плотность материала
- Так что плотность ρ = 1.74 г/см³ практически однозначно свидетельствует, что это не сплав. Это магний и вполне себе чистый: или Ч или ЧДА или ХЧ.
- Примечание. Почему автор так долго и нудно рассказывал, показывал и объяснял
- Но в промежутке 1:22-2:42… это какая-то полярная лисичка. Сначала было сделано некорректное определение объема образца. А потом пошло-поехало…
- Ну что, жгём магний? Не жгём, а жжём…
- Заключение
Давным-давно для одного проекта было куплено немного магния. По заявлению продавца — высокой чистоты. Проект так и не был запущен. А магний остался.
Живьем
Было куплено два магниевых цилиндра
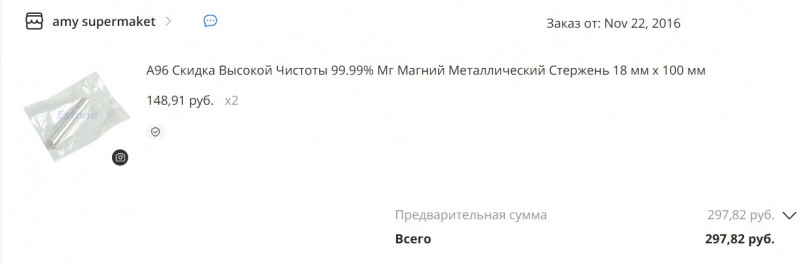
Один где-то валяется. А второй так и остался в запаянной металлизированной упаковке

Вскрытие герметизированной упаковки: цилиндр в тонкой пищевой полиэтиленовой пленке, завернут как конфетка

А вместо конфетки — вот такое. Черные пятна — заводская грязь. Это не следы окисления, ибо MgO — белый.

Магниевый пруток резали фрезой на станке. Борозды на торцах цилиндра строго параллельны.

Забавно, но место среза выглядит очень свежим — сияет во всю, хотя прошло почти 6 лет. На фото я это дело поборол как мог — что бы были видны следы от фрезы.
Плотность материала
Самый простой способ проверки образца на соответствие заявленным 99.99% Mg — найти его плотность.
Для определения плотности измерим массогабариты

Диаметр постоянен по всей длине (концы, середина). Вращение дает отличия не более 0.005 мм.

С длиной — чуть сложнее из-за следов фрезы.
Губки штангеля параллельны бороздам на металле:

Губки штангеля перпендикулярны бороздам:

Расчет:
ρ = m/V; V = Sh; S = πR = πD²/4; V = πD²h/4
ρ = 4m/(πD²h)
m = 43.3 г; h = 9.947 см; D = 1.7865 см
ρ = 4•43,3/(9.947•3,1416•1.7865²) = 1.736596…
ρ = 1.74 г/см³
Результат расчета округлен до третьей значащей, т.к. наименее точно известная величина m = 43.3 имеет 3 значащих циферки. Хотя был большой соблазн округлить до четвертой значащей (1.737) и вот почему.
Дело в том, что в Вики для магния указана плотность 1,738 г/см³ и температура плавления 650°C. Ссылаются на этот ресурс:

А 1,737 г/см³ отличается 1,738 г/см³ всего на одну тысячную!
Но мы не поддаемся на провокации и не подвержены соблазнам.;) Это просто совпадение.
Кстати, в интернетах нашел забавную книжку


Все, что подчеркнуто — будет полезно.
1) Плотность указана та же самая. Возможно дернули из Вики, но Тпл почему-то отличается на градус.
2) То, что место среза за 6 лет заметно не окислилось объясняется 3 причинами:
— магний в бруске, а не в виде порошка
— большая часть воздуха была откачана перед запаиванием
— магний достаточно чистый; чем чище металл, тем он менее склонен к окислению кислородом воздуха
3) То, что подчеркнуто синим — это дополнительная проверка «на магний».
Вернемся к плотности. То, что фактическая плотность совпадает с заявленной для практически чистого магния не может не радовать. Но может быть, это сплав магния с такой плотностью?
Нет.
Очень ясно и кратко все изложено Тольяттинской методичке, ЛР по материаловедению. В веб-варианте она ТУТ

Так что плотность ρ = 1.74 г/см³ практически однозначно свидетельствует, что это не сплав. Это магний и вполне себе чистый: или Ч или ЧДА или ХЧ.
ГОСТ 13867-68 — Продукты химические. Обозначение чистоты:


И еще один интересный момент из той же методички:
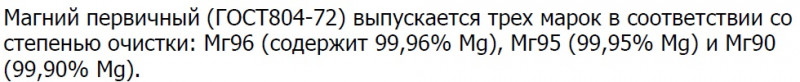
ГОСТ 804-72 действует до сих пор. Там нет ничего интересного, кроме этой таблички:
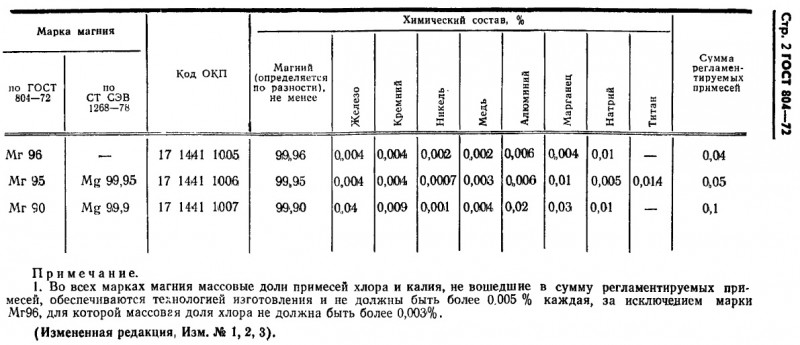
Китайские стандарты я не нашел. Но так как советские технологии активно передавались в КНР на протяжении полувека, то смею предположить, что у китайцев что-то сильно похожее.
Так что насчет четырех девяток (99.99% Mg) китайцы скорее всего погорячились. Максимум — Мг96 (99.96%) Но даже если магния там «всего» только три девятки (99.90%, Мг90) — это тоже неплохо.:)
Примечание. Почему автор так долго и нудно рассказывал, показывал и объяснял
Нельзя ли было покороче и попроще? Да легко! Но тогда вряд ли можно было бы доверять полученному результату.
Просто великолепный, образцово-показательный пример такого подхода я нашел на Ютьюбе. Когда обзор был уже сверстан. И пришлось лепить данный раздел. Тоже долгий и нудный;).
Вот он — замечательный ВИДОС на канале Химикат-7.
Кстати, если вымарать из ролика тяжелую муть (которая будет рассмотрена ниже), то он станет очень даже. Полезным и познавательным.
Но в промежутке 1:22-2:42… это какая-то полярная лисичка. Сначала было сделано некорректное определение объема образца. А потом пошло-поехало…
Итак, рассматривается точно такой же кусок магниевого прутка, как в этом обзоре. Только длиной не 10, а 9 см.
Просто сейчас большая часть лотов на Али именно такие. Хотя цилиндры по 10 см тоже встречаются, их продают реже и немного дороже.
Так вот, сначала влогер рассказывает какую-то мутную историю про костер. Потом, он заявляет, что его «начинают терзать смутные сомнения»… И он решает определить плотность прутка.
► Далее приводится найденный автором объем образца. ВНИМАНИЕ: но не указывается и не показывается как и чем он измерял длину и диаметр цилиндра!
► Потом он измеряет массу и показывает это. И на том спасибо
► Расчет плотности, ρ = 1.779 г/см³. Я проверил — поделил он правильно.
► И вот здесь пока остановимся. Влогер Химикат-7 определял плотность точно такого же прутка, как и у меня. Но он ошибся. Ошибся в определении объема образца.
И все бы было ничего — ну ошибся и ошибся. Но автора канала вдруг понесло. Он много чего понапридумывал, а потом просто обманул зрителей. Ибо аналитическую химию в вузах изучали единицы и многие из изучавших уже давно все позабывали. Именно момент обмана переполнил мою чашу терпения и «рука потянулась к пистолету»… Прошу извинить меня за несдержанность.
У меня есть подозрение, что измерения длин были проведены миллиметровой линейкой. Попробуем разобраться, может ли такая вроде невинная шалость привести к столь печальным последствиям.
1) Для начала предположим, что плотность была определена правильно (1.738 г/см³), а погрешность в измерении массы равна разрешающей способности весов (чушь конечно, но здесь так надо) m = 32.18 г. Найдем V₀ образца, соответствующий данной ситуации
ρ₀ = m/V₀
V₀ = m/ρ₀ = 32.18/1.738 = 18.515535… = 18.52 см³
или
π•D₀²•h₀/4 = 18.52 см³, где D₀ и h₀ — диаметр и высота цилиндра, измеренные вменяемым штангелем.
А при измерении линейкой D₁ и h₁ получено
π•D₁²•h₁/4 = 18.09 см³
Получаем систему уравнений
π•D₀²•h₀/4 = 18.52
π•D₁²•h₁/4 = 18.09
или
D₀²•h₀ = 23.58
D₁²•h₁ = 23.03
2) Пусть ошибка измерения линейкой величин D₁ и h₁ одинакова и равна x = — 0.1 см (цена деления линейки). Тогда:
D₀²•h₀ = 23.58
(D₀ — 0.1)²• (h₀ — 0.1) = 23.03
Получаем систему из 2-х уравнений с двумя неизвестными. В принципе — решаемо. Но я заколебался ее решать (аналитически). Потому как оба уравнения немножко нелинейные.
Поэтому «мы пойдем другим путем» ©, как нам в прошлом и было завещано.
А на самом деле, как сейчас говорят, «есть два путЯ»:
— фиксируем D₁ и начинаем играться с h₁ для получения фатального значения 18,09 см³
— фиксируем h₁ и находим, при какой погрешности D₁ будет рассчитан неверный объем 18,09 см³
3) Пусть D₁ = D₀ (диаметр определен верно), x — ошибка измерения линейкой высоты цилиндра (см).
Тогда:
D₀²•h₀ = 23.58
D₀²•(h₀ — x) = 23.03
Делим верхнее на нижнее
h₀/(h₀ — x) = 23.58/23.03 = 1,024
h₀ = 1.024•h₀ — 1.024•x
x = 0.023•h₀
При характерной высоте h₀ = 9 см получаем x = 0.2 см = 2 мм.
Мог ли Химикат-7 ошибиться на 2 мм при изменении 90 мм? В принципе — да. Но это вряд ли, ежели линейка не кривая.
4) Ладно, посмотрим что нас ждет на втором пути.
Пусть h₁ = h₀ (высота определена верно), y — ошибка измерения диаметра цилиндра (см).
Тогда:
D₀²•h₀ = 23.58
(D₀- у)²•h₀ = 23.03
Делим верхнее на нижнее
D₀²/(D₀ — y)² = 23.58/23.03 = 1.024
D₀/(D₀ — y) = √(1,024) = 1.012
D₀ = 1.012•D₀ — 1.012•y
y = 0.012•D₀
При диаметре D₀ = 1.80 см получаем y = 0.02 см = 0.2 мм. И это при цене деления миллиметровой линейки 1 мм. Т.е., линейка имеет в 5(!) раз худшую разрешающую способность, чем необходимая и достаточная ошибка измерения диаметра цилиндра для получения ошибочного значения объема 18.09 см³…
Занавес.
Прим. Для тех, кто обладает зрением как у орла, разрешающая способность линейки может быть принята 0.5 мм. Тогда «в 5(!) раз» ➜ «в 2,5(!) раза». Хрен редьки не слаще.
► Затем автор приводит значение 1.738 г/см³ из Викей
И с этого момента началось натягивание совы на глобус.
Ибо, «преступление раскрыто»: расчет показывает, что магний не чистый.
Далее — еще два «открытия». Первое является следствием обычной неосведомленности, а второе — безграмотности:
— магний «разбадяживали», предположительно алюминием
— алюминия в образце 4 %…
Влогер даже показал зелененьким перманентом сколько там «левого» люминя
Ну что можно сказать…
1) Магний «разбадяживать» алюминием или еще чем-то нет никакого смысла. Да, первичный магний, идущий прямо с завода имеет весьма высокую степень очистки: 99.90-99.96%. Но зачем его «разбадяживать»? Это же дополнительные затраты денег, времени и ресурсов. Чтобы сделать дороже или из вредности? Или магний такой ценный/редкий? Магний — один из десяти наиболее распространенных элементов земной коры. В ней содержится 2.35% магния по массе.
2) Почему именно алюминий — ну это он просто так предположил. А вот как было получено 4% Al — я сейчас покажу. И объясню, что 4% — это вилами по воде. Химикат-7 скорее всего неявно предполагает, что сплавы Mg-Al представляют собой механическую смесь из двух фаз. Плотность такой смеси от чистого Mg до чистого Al изменяется линейно. Расчет элементарен.
Путь х — массовая доля алюминия, тогда массовая доля магния (1 — х).
Плотности: ρ(Mg) = 1.738 г/см³, ρ(Al) = 2.700 г/см³, ρ(сплава) = 1.779 г/см³.
(1 — х)•ρ(Mg) + х•ρ(Al) = ρ(сплава)
х = (ρ(сплава) — ρ(Mg))/(ρ(Al) — ρ(Mg))
х = (1.779 — 1.738)/(2.700 — 1.738) = 0,04261… = 4,3%
Эх, если бы химик-энтузиаст знал, что есть такие штуки — фазовые диаграммы и при этом понимал их смысл…
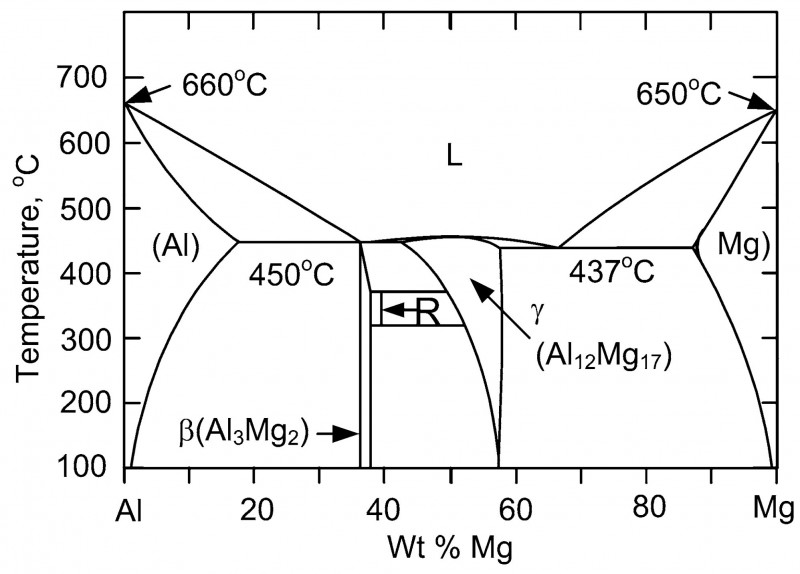
Короче, смотрим фазовую диаграмму для системы Mg-Al:
Из нее напрямую следует, что сплавы Mg-Al не являются механическими смесями. Mg с Al образуют химические соединения (соединения между металлами называются интерметаллидами) в количестве нескольких штук. Толи трех, толи четырех. А кроме того, как сами Mg и Al, так и их интерметаллиды, образуют твердые растворы, т.к. являются фазами переменного состава.
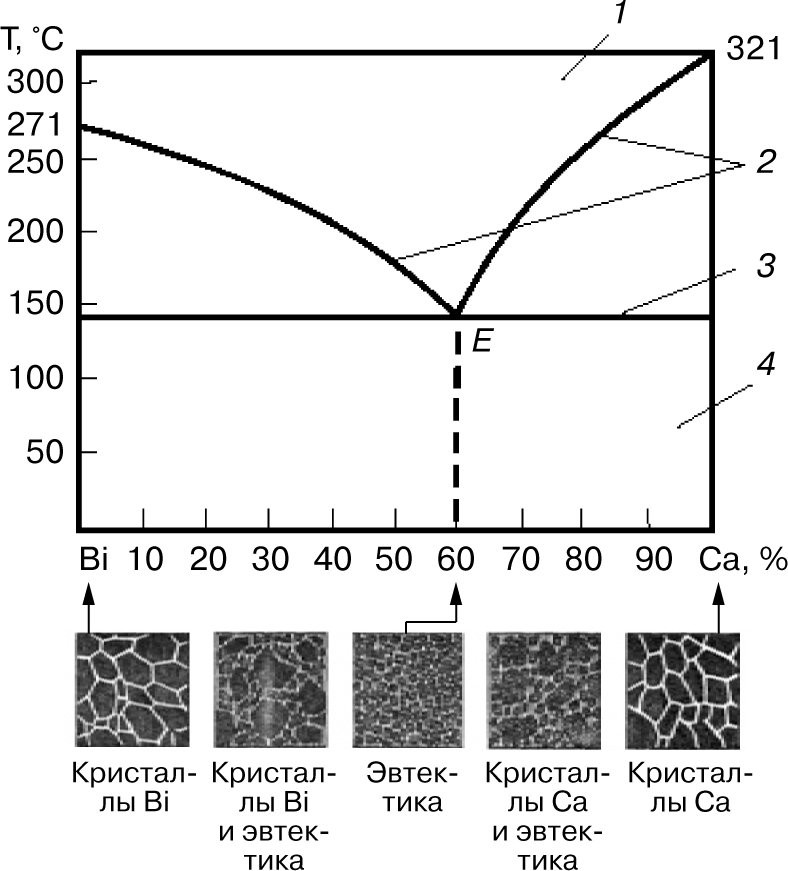
Механическая смесь двух компонентов А и В образуется тогда, когда при кристаллизации компоненты сплава не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Рентгенограмма сплава отчетливо показывает наличие двух решеток компонентов А и В. [Аксиома для всех, кто изучал химию твердого тела]
Хрестоматийным примером механической смеси является система висмут-кальций
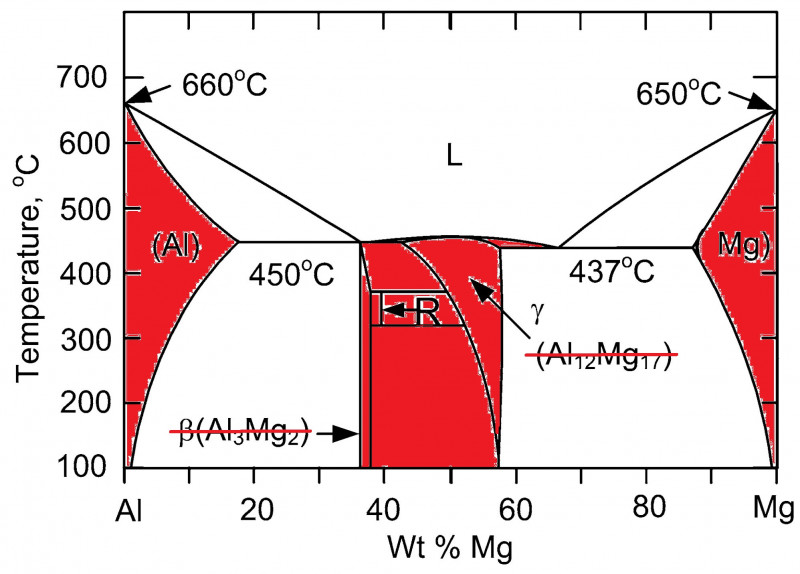
Вот ежели бы фазовая диаграмма Mg-Al имела такой же вид как для системы Bi-Ca, то приведенный выше расчет массовой доли Al по ρ(сплава) был бы верен. А в системе Mg-Al все с точностью до наоборот: Mg и Al способны к взаимному растворению в твердом состоянии и вступают в химические реакции с образованием соединений… Думаю, меня уже никто не понимает. Ладно, просто показываю пальцем: красным отмечено то, чего не должно быть на фазовой диаграмме, в случае механической смеси
В результате, от Mg до Al плотность меняется нелинейно, причем немонотонно — волнами. Короче, надо приготовить 100 сплавов через 1% и тупо определить их плотность. Только с использованием не линейки, а штангеля.;) А теоретизировать бессмысленно.
► И вот мы подошли к апофеозу. Влогер показал вот ЭТО:
Химикат-7: " Реакция с ализариновым красным подтверждает наличие алюминия".
На самом деле, то, что было показано — это НЕ качественная реакция на ион Al⁺³.
Это всего лишь переход окраски ализарина при увеличении pH (слабокислая среда ➜ слабощелочная среда).
Дело в том, что ализариновый красный — это хорошо известный кислотно-основный индикатор:
pH < 5.9 жёлтый
pH = 5.9 — 7,0 желто-розовый
pH = 7,0 — 10.1 розовый
pH = 10.1 — 12.0 тёмно-розовый
pH > 12.0 фиолетовый.
А вот как выполняется аналитическое определения алюминия двумя способами в классическом качественном анализе:
Обратите внимание, что должно наблюдаться и что показано в сабжевом видосе.
Понятно, что глубоко разбираться во всем этом нет никакой радости. Тем паче, если ты не в аналитической лаборатории и нет конкретной задачи идентификации присутствия иона Al⁺³ в анализируемой смеси катионов и анионов неизвестного состава. Я долго искал, но нашел-таки немецкий ролик, дающий представление о последовательности действий химика-аналитика. Причем, в самой простой ситуации — определение алюминия в отсутствии мешающих (они называются «маскирующие») катионов 4 аналитической группы. Критерием качественного определения алюминия является получение осадка комплексной соли алюминия с ализарином в слабокислой среде (не растворяется в разбавленной уксусной кислоте):
Там же показано, что маскирующие ионы (например, Fe⁺³) тоже дают осадки, правда несколько иного цвета
По этому вопросу — у меня всё. Доклад закончил.
ПС. В остальном канал Химикат 7 действительно интересный, там есть чего посмотреть. В конце обзора будет ссылка на видео с этого канала — автор показал «работу» кучи термитных смесей. Более 25 шт.! Аналогов такого обобщающего видео в интернетах нет.
Ну что, жгём магний? Не жгём, а жжём…
Чем отличается магний от алюминия? Как пироматериал?
Тем, что магний можно сжечь прямо на воздухе. При этом он сам будет поддерживать свое горение. И не только в виде порошка, но и в виде стружки и даже нетолстой ленты. А вот алюминий — фигвам. Все, кто пользовал пищевую алюминиевую фольгу (делается из чистого алюминия) на барбекю или прямо на углях костров хорошо знают — при желании (скорее — с дуру) прожечь ее можно. Точнее — проплавить. Наскрозь. Но она не поддерживает свое горение на воздухе. Точно так же не поддерживают самопроизвольное горение и порошки алюминия, в т.ч. общеизвестная «алюминиевая пудра». Что бы она горела, ей надо «помогать»:
А вот магний — он поддерживает свое горение на воздухе.
Почему?
Защитная пленка на магнии не столь прочна и однородна как на алюминии. Но это еще не все, а только начало. Главное: разогретый магний на 6 (шесть!) порядков более летуч, чем алюминий.
«Летучесть магния значительно превосходит летучесть алюминия. Так, при 1300 К упругость паров магния почти на 6 порядков выше, чем упругость паров алюминия: 4,00 • 10⁴ и 6,27 • 10⁻² Па соответственно»
Хайкин Б. И., Блошенко В. Н., Мержанов А. Г. О воспламенении частиц металлов // Физика горения и взрыва. 1970. Т. 6. № 4. С. 474-488.
Для полного понимания: 4 • 10⁴ Па — это 40%(!) относительно нормального атмосферного давления (1 атм).
Т.е., массово испаряющиеся при горении и крайне агрессивные молекулы Mg₂ практически мгновенно окисляются кислородом воздуха до MgO. Да и азотом тоже, с образованием нитрида Mg₃N₂. Ибо магний проявляет ярко выраженную диагональную аналогию с литием… Ой, меня понесло. Это секретная информация: под грифом «только для химиков».:)
Как проводят опыты с горением металлического магния на воздухе в вузах.
Это будет нужно для правильного понимания результатов экспериментов, проведенных мною.
На лабораторных работах студенты сжигают небольшие кусочки магниевой ленты. Просто зажимают кусочек щипцами для тигля или зажимом для пробирок и суют в пламя спиртовки. Через несколько секунд магний загорается и сгорает ослепительно-ярким ровным белым пламенем. Типа как в этом видосе. Образуется нечто белое (смесь MgO+Mg₃N₂), которую переносят в пробирку, заливают водой, определяют рН универсальной индикаторной бумагой и т.д. и т.п.
На лекциях преподаватели показывают демонстрационный опыт со стружкой Mg. При нагревании на спиртовке тонкого листа жести с горкой магниевой стружки, она сначала начинает искрить, а потом происходит яркая вспышка. Как-то я спросил у лекционного ассистента почему стружка, а не порошок? На складе кафедры навалом баночек с уже готовым магниевым порошком — студенты делают опыты на лаб. работах. А стружку приходится специально изготавливать на металлообрабатывающих станках в институтских мастерских. Оказывается — пробовали они тот порошок. При желании поджечь его можно, но горит он вяло и неинтересно для студентов.
► Но я все-таки пилил порошок. Обычным драчевым напильником. Потому как дрель сделала ноги в неизвестном направлении, уже несколько месяцев не можем найти.
Опыты проводились с маленькими навесками, меньше 0.1 грамма:

Потом запечатывал пакетик из кальки и запихивал в кулечек из кальки:

Получившуюся закрутку поджог и…

… бумага сгорела, магний не загорелся. Тогда я повторил опыт, но дополнительно облил закрутку спиртом. Спирт сгорел, бумага сгорела, магний не загорелся.
► Настало время думать, а не продолжать трясти дерево (как в известном анекдоте). Главная проблема — навеска не успевает разогреться до Т начала горения.
Решил кардинально изменить структуру опыта. Во-первых, слепил нечто напоминающее спиртовку — обернул пробку от пластиковой бутылки алюминиевой фольгой. На жестяную емкость положил пару деревянных палочек (по фэншую). А сам магний поместил в импровизированную лодочку-тигелек из нескольких слоев фольги. В середине лодочки было сделано прямоугольное углубление и порошок был распределён в нем тонким слоем. Вот, что произошло дальше:
С самого начала все пошло через одно место: первая палочка загорелась еще до установки лодочки. Через несколько секунд вспыхнула вторая. Горение было бурным, но камера не зафиксировала самое главное, ибо матрице не хватило динамического диапазона по яркости. Глаза видели прямоугольник порошка, светившийся ярко-розовым. А над ним и по всему объему лодочки бушевало пламя (горящий газообразный магний — ?). В результате все обрушилось на спиртовку… и все это догорающее и дымящееся я отправил в унитаз. Во избежание.
► Опять стал чесать репу. В конце-концов обернул алюминиевой фольгой еще одну крышечку и насыпал туда порошок. Горкой.
Все-таки надо было выключить свет. Что бы свечение магния при его спокойном горении различалось лучше.
► Оказалось, что горение происходило только по поверхности горки порошка. Большая часть магния не сгорела. Алюминий тоже не пострадал.


Аналогичное было зафиксировано в этом видосе. Но юноша ковырял магниевый порошок в процессе его самоокисления на воздухе. Под конец ему таки удалось получить яркое горение. Я до этого момента не допер. А видос тот нашел только после окончания экспериментов.
Так что, при сжигании магниевого порошка без какого-либо дополнительного окислителя, не ждите фаер-шоу. Оно может случится только в том случае, если вам придет в голову «еле тлеющий» порошок магния залить водой.
Заключение
На основании моего скромного опыта химика я хотел бы предупредить…
1) Не нужно думать, что магний в виде порошка — штука практически безопасная, белая и пушистая. В отличии от стружки или той же ленты. В проф. пиротехнике применяются исключительно порошки магния, алюминия, ПАМ, циркония, титана и т.д. ПАМ — это «порошок алюмо-магниевый», изготавливается из сплава алюминий-магний, а не смешиванием порошков двух металлов.
2) Понятно, что для изготовления наколенного свето-шумового устройства (что бы порадовать прохожих, одноклассников и руководство школы) совершенно не нужен чистый магний. Тем паче, из-за бугра и по такой цене. В прошлой жизни любой советский школьник начальных классов был прекрасно осведомлен, где можно было надыбать всяко-разное из магниевых сплавов. И практически за бесплатно. Намекаю — авиация.
3) Имейте ввиду, что магний намного активнее алюминия. Поэтому длительное хранение порошка или стружки желательно в герметически закупоренных негорючих емкостях. Типа стеклянных или жестяных банок. Но наиболее безопасное хранение — в компактном виде, типа сабжевого цилиндра.
В отличии от алюминия, магний:
— реагирует даже с чистой водой (с холодной — оч. медленно, с кипящей — пошустрее)
— не реагирует с р-рами щелочей
— зато активно взаимодействует с р-рами любых кислот, даже очень слабеньких (уксусная, лимонная, щавелевая)
4) Горящий магний нельзя тушить водой. Может произойти большой бабах.
Горящий магний нельзя тушить углекислотой — в атмосфере углекислого газа он горит ничуть не хуже, чем на воздухе. Оптимальный способ тушения — засыпать сухим песком.
5) Самое жуткое — это горение термитных составов. Магний или алюминий в виде порошка + порошок оксида менее активного металла (ZnO, Fe₂O₃, Fe₃O₄, CuO и т.п.) или неметалла.
Печаль в том, что остановить протекание такого взаимодействия вообще нельзя. Известными способами. Там окислитель и восстановитель уже в смеси, а тепла выделяется мама родная.
Всего доброго.
P.S. Сообщения об опечатках-ошибках пишите прямо сюда, в комменты. Спасибо за понимание.